ガイドライン
X-SCIDおよびJak3欠損症に対する同種臍帯血移植療法
厚生労働科学研究費補助金 難治性疾患克服研究事業
「原発性免疫不全症候群に関する調査研究」班 ガイドライン
ガイドライン提示にあたって
重症複合免疫不全症に対する造血幹細胞移植は、移植前処置をするかどうか、どのような移植前処置を選択するかなど、 造血幹細胞移植の選択に関して難しい問題が多く残されている。当研究班は今回、これまでの国内および海外の長期的な 成績を含めた情報を基に現時点で最善と考えられる造血幹細胞移植法を提示するが、その適応は個々の症例で十分検討すべきであり、 このガイドラインの作成委員、ガイドライン検討委員会委員等と十分検討することが望まれる。 また移植症例数など国内の状況を把握するためにも、移植責任者から当ガイドライン事務局へ移植予定症例の発生について連絡をお願いしたい。
背景と目的
X-SCID、Jak3欠損症ではT細胞とNK細胞の分化障害があり、B細胞数は正常または増加しているが 抗体を産生できず機能的に異常であるという免疫学的特徴を有する1)。そのため、生後数カ月から慢性の下痢、間質性肺炎、 持続性カンジダ症などの重症感染症を発症し、成長障害に陥る。アスペルギルス、ニューモシスチス・ジロヴェチ、 サイトメガロウイルスなどによる日和見感染症もよく経験される。責任遺伝子はγc鎖遺伝子およびJak3遺伝子である。 本疾患は約10万人に1人の割合で発症する。X-SCIDに対する一般的な治療法は造血幹細胞移植で、骨髄移植などの適切な治療が 施されなければ重症感染症により乳児期に死亡する1)。 このため診断がつき次第、造血幹細胞移植を行なう。最近では遺伝子治療の報告も見られるが、副作用の問題もあり、 まだ一般的とはいえない2)。
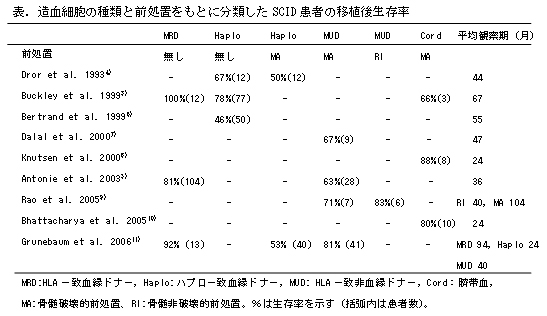
X-SCID患者は免疫能を欠如するため輸注した造血細胞が生着しやすく、HLA一致血縁ドナー(MRD)からの造血幹細胞移植では前処置を 行わなくても免疫構築が期待でき、B細胞はレシピエントのままのことが多いが90%以上の患者で免疫不全の状態が軽快する3)。 しかし、家族内にHLA一致ドナーが見つかる確率は、現在の日本の同胞数からいって20%に満たないものと考えられる。 そのためHLA一致血縁ドナーの存在しない患者に対する造血幹細胞移植では、HLA一致非血縁骨髄ドナー(MUD)か HLAハプロ一致血縁骨髄ドナー(Haplo)を選択する必要がある。 骨髄破壊的移植前処置の後、MUDあるいはHaploで移植した場合の長期生存率は表に掲げるとおりMUDで63-81%3-5)、 Haploで46-78%6-8)である。さらにHLA一致ドナーおよびHLAハプロ一致血縁ドナーから前処置無しで造血幹細胞移植を 受けた72症例のうち45症例(62.5%)では免疫グロブリンの産生欠損が残り、生涯にわたる免疫グロブリン補充療法が必要となったと 報告された7)。 さらに移植後長期間のうちに一旦生着したT細胞が枯渇しやがて再び免疫不全の状態に陥ることが指摘されている1)。 同様の移植成績がヨーロッパからも出されており、FischerらはB+SCID患者の約80%で移植後免疫グロブリン置換療法が必要と なったと報告している1)。 一方、ブスルファン(BU)+シクロホスファミドなどの骨髄破壊的前処置を用いた非血縁ドナーの移植では、 移植片対宿主病(GVHD)のほか、移植前処置に用いる抗癌剤の影響で治療関連毒性や晩期障害が起こる頻度が高くなってくる3-5, 9)。 移植早期には前処置に用いた抗癌剤による血液毒性による白血球、赤血球、血小板の減少がみられ、易感染性、貧血、 出血傾向となる。さらに肝障害、肝静脈血栓症、下痢、腎障害、心毒性、肺合併症など様々な合併症を伴う。 晩期合併症としては二次癌、成長障害、内分泌障害、性腺機能障害など患者のQOLに関わる重大な合併症が起こってくる。 特にBU投与後の妊孕性の喪失は男女ともにみられると報告されている10)。
このため最近骨髄非破壊的造血幹細胞移植が試みられるようになった。症例数は6例と少ないが英国から83%の 生存率がえられたと報告されている5)。この報告は原発性免疫不全症患者に対する非血縁者間の 骨髄破壊的前処置施行例19例と骨髄非破壊的移植症施行例33例の治療成績を比較したもので、前者では平均観察期間104ヶ月で 生存例10例全例が免疫グロブリン補充療法を必要としなくなったのに対し、後者では平均観察期間40ヶ月で生存例31例のうち5例 (16%)で免疫グロブリン補充療法が必要となった。しかし、造血幹細胞移植後のSCID患者に限った免疫グロブリン補充療法の 有無については記載がなく不明である5)。 さらに非血縁者間臍帯血移植(Cord)も行われるようになり、やはり症例数は少ないながら66-88%の生存率が得られている 11-12)。本邦でも厚生労働省の「原発性免疫不全症候群に関する調査研究」班が全国調査を実施し、 その集計を行なったところ、造血幹細胞移植を受けたB+SCID患者は45名、生存31例(うち2例は再移植)、 死亡14例となっている。生存例のうち免疫グロブリン補充療法を中止できたのは17例で、骨髄破壊的前処置施行例5例、 骨髄非破壊的前処置施行例5例、前処置無し7例(うちHLA一致兄弟からの移植4例)を含んでいた。一方、 免疫グロブリン補充療法が必要な症例12例では、骨髄破壊的前処置施行例1例、骨髄非破壊的前処置施行例1例、 前処置無し10例であった13)。以上のように、X-SCIDやJak3欠損症患者に対する造血幹細胞移植後に免疫グロブリン補充療法が 必要になる割合は、前処置無しでの移植の場合60-80%である。これに対し、骨髄破壊的前処置では免疫グロブリン補充療法が ほとんど必要なくなる。しかし、骨髄破壊的前処置を施行した場合、生命予後に直接関わる感染症や移植関連毒性のため 生存率が低くなり患者のQOLも悪くなってしまうという問題点がある。
一方英国からの報告のようにフルダラビン(FLU) 150 mg/m2+メルファラン(L-PAM) 140 mg/m2 +Campath 1H (またはATG)による骨髄非破壊的前処置を行なった症例では生命予後に関わる移植関連毒性の発生頻度は低くなっている。 SCIDでは悪性腫瘍に対するような強力な前処置は必要なく、B細胞機能の回復を含む十分な免疫構築が得られさえすれば良いことから、 治療関連毒性や合併症を回避することのできる最小限の抗癌剤を用いた前処置を工夫することが望ましい。以上を基に、 今回、FLU 150 mg/m2+L-PAM 140 mg/m2の前処置を設定した。
他方、国内の報告によると、FLU 180mg/m2+BU 8mg/kg (経口BU 2例、静注BU 1例)という骨髄非破壊的前処置を 用いてX-SCIDに対してUCBTを単施設で施行した3例すべてで完全キメラを獲得し、免疫グロブリン補充を早期に中止できたという報告が なされたこと14からSCIDに対するRICレジメンの候補として有力と考えられる。BUは移植早期および晩期副作用が懸念されている。 経口BUでは、腸管吸収の違いなどから血中濃度のばらつきが多く、その一方で小児では成人と比較してクリアランスが4-5倍高いとされていた。 しかし、静注BUの登場によって血中濃度が安定することが期待される。対象疾患は血液腫瘍であるがFLU 150mg/m2 +L-PAM 100-140mg/m2とFLU 150mg/m2+BU 6.4mg/kgの比較では、急性GVHDと非再発死亡率は FLU+BUが低頻度であったという報告もなされている15)。 移植早期の感染症についても、BU+CYが比較的安全に施行できていることからより軽減した前処置であるFLU+BUは安全に施行できると考えられる。 また晩期合併症としての性腺機能障害については、BUを高容量16-20mg/kgで投与した14名中7例では発症したが、 低容量8mg/kgを投与した7例では全例性腺機能障害はなかったと報告されている16。
上記の報告を基に、X-SCIDおよびJak3欠損症に対する造血幹細胞移植法として、 HLA適合同胞のいない場合、移植前処置として、FLU+L-PAMおよび、FLU+BUの 二つの骨髄非破壊的前処置の二つのプロトコールを現時点での骨髄非破壊的前処置を含む臍帯血移植として推奨するものである。
このガイドラインは、移植前処置なしでの臍帯血移植や、その他の適切な方法による造血幹細胞移植を制限するものではなく、 今回提示する二つの移植前処置を含め移植方法の選択・決定は主治医の判断による。
これらの移植前処置に耐えられないと考えられる感染症などの合併症がある場合には、前処置をせずに移植を行うべきである。
国内でこのガイドラインによる治療成績をより明確にするために、症例登録、観察研究を開始予定です。事務局までお問い合わせください。
ガイドライン責任者
九州大学大学院医学研究院成長発達医学分野・教授・原 寿郎
ガイドライン作成責任者
東北大学大学院医学系研究科小児病態学分野・教授・土屋 滋
ガイドライン作成委員
富山大学大学院医学薬学研究部小児科学・教授・宮脇 利男
北海道大学大学院医学研究科小児科学分野・教授・有賀 正
防衛医科大学校医学研究科小児科学・教授・野々山 恵章
東京医科歯科大学大学院発達病態小児科学分野・准教授・森尾 友宏
信州大学大学院医学研究科移植免疫感染症学・准教授・上松 一永
名古屋大学大学院発育・加齢医学講座小児科学・教授・小島 勢二
ガイドライン検討委員会
委員長:久間木 悟 みやぎ県南中核病院
委員:森尾友宏 東京医科歯科大学大学院
金兼弘和 富山大学大学院医学薬学研究部
高田英俊 九州大学大学院医学研究院
蒲池吉朗 名古屋大学大学院医学研究科
上松一永 信州大学大学院医学研究科
有賀 正 北海道大学大学院医学研究科
今井耕輔 防衛医科大学校医学研究科
野々山恵章 防衛医科大学校医学研究科
土屋 滋 東北大学大学院医学系研究科
笹原洋二 東北大学大学院医学系研究科
ガイドライン事務局
|
九州大学大学院医学研究院成長発達医学分野・高田英俊 〒812-8582 福岡市東区馬出三丁目1-1 電話 092-642-5421 FAX 092-642-5435 | |
| E-mail: |
 |
対象
同種造血幹細胞移植の適応があると考えられる生後3ヶ月以上15歳未満のX-SCIDおよびJak3欠損症のうち HLA genotype一致血縁ドナーが得られない症例。
造血幹細胞移植法概要
臍帯血移植日をday 0とする。
(1) 移植前処置
以下の(a)あるいは(b)を選択する。
ただし、移植前処置なしでの移植を制限するものではない。
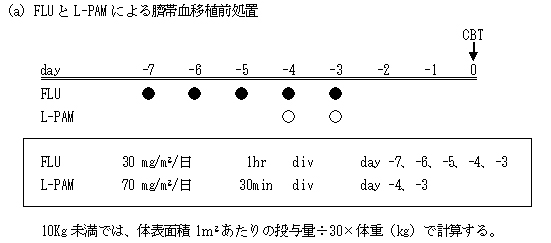
FLUは2.5 mLの生理食塩液に溶解し必要量を生食20 mL以上に希釈する。その後1時間点滴にて投与する。
L-PAMは添付溶解液を加えて激しく振盪し、その後20 mL以上の生食に希釈する。その後30分で点滴投与する。
< 注意事項 >
前処置開始前日から十分な輸液を行うこと。FLUとL-PAMを同日に投与する日の両者の投与間隔は4時間とする。また制吐剤も適宜使用する。
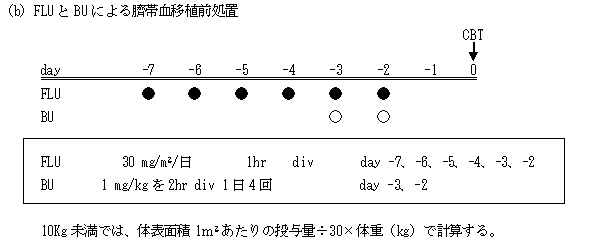
FLUは2.5 mLの生理食塩液に溶解し必要量を生食20 mL以上に希釈する。その後1時間点滴にて投与する。
BUの投与経路は、直接末梢静脈に投与すると薬液の漏出による局所組織障害を起こすことがあるので、 必ず中心静脈からの点滴静脈内投与とし、皮下、筋肉内には投与しない。10倍量の生理食塩液又は5%ブドウ糖液に添加し、 十分に混和して使用する。室温(約25℃)で用時調製し、調製から8時間以内に投与を終了する。 調製後に混濁又は結晶が認められる場合は使用しない。ポリカーボネート製の容器・シリンジ等及びポリエーテルスルホン製 のシリンジフィルターは使用しない。本剤の投与においては希釈調製された全量が1回2時間で投与されるよう、 持続注入ポンプを用いて点滴静脈注射する(急速静脈内投与を行わない)。
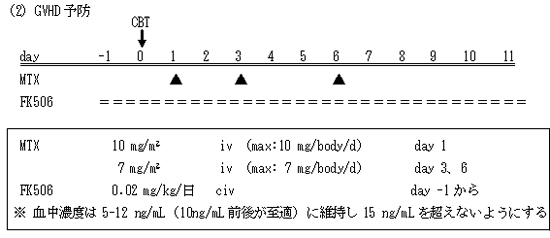
タクロリムス血中濃度は5-12ng/mLに維持し(10ng/mL前後が至適)15ng/mLを超えないようにする。なおタクロリムスは内服が 可能となった時点で1日点滴量の3-5倍量を分2で内服とする。
またメトトレキサートについて、day 1においては一回最大10 mg/bodyとし、day 3、6においては一回最大7 mg/bodyとする。
移植細胞源・細胞数およびドナーのHLA適合度
移植細胞源は非血縁臍帯血とする。この理由は緊急を要するX-SCIDおよびJak3欠損症の移植では、 移植の準備に数ヶ月を要する骨髄バンクを介しての移植は適さないことと、国内SCIDの造血幹細胞移植症例の 集計で非血縁臍帯血移植の粗生存率が非血縁者間骨髄移植および血縁者間HLA不一致骨髄移植に比べて良好であったこと (77.8% vs 50.0% vs 58.4%)13)である。またHLA不一致非血縁者間臍帯血移植においては 生着不全やGVHDの頻度が高まることが予想されるため、本試験では通常の非血縁者間臍帯血移植の基準に準じて 血清学的にHLA-A, B, DRが2座不一致までに限りドナーとして選定する17)。
移植細胞数の最低数は2 x 105/kgとし、CD34陽性細胞が多く含まれる臍帯血を選択する。 ドナーの性別や血液型は問わない。
移植後の免疫能の検査のフォローの仕方、ガンマグロブリン投与の目安
1. 移植1、2、3年後(±1カ月)でのIgG補充の適応について
原則として、移植後3カ月以上IgG補充療法を行わなくても血清IgG 濃度が500mg/dl以上を維持できている場合、 IgG補充療法の必要は無いと考える。ただし、IgG補充の必要性については感染症の発症などを勘案して総合的に判断されるべきであり、 症例によっては、より高い血清IgG濃度を維持する必要がある。
2. 生着、免疫能に関する評価項目
a) 好中球数≧500/mm3、血小板数≧5×104/mm3、網状赤血球数≧10‰のそれぞれの到達日数
b) lineage(T細胞、B細胞、NK細胞、顆粒球、単球)毎のキメリズム解析*
c) 免疫学的評価(CD3, CD4, CD8, CD19, CD16/56, IgG, IgA, IgM, IgE, PHA/ConAによるリンパ球芽球化反応、NK活性)
b)、c)については、移植日をday 0として、day 60, 180及び1年目、2年目、3年目の末梢血で検査を行なう。
Lineage毎のキメリズム解析等に関するお問い合わせ:
ガイドライン事務局(九州大学小児科 高田英俊 takadah@pediatr.med.kyushu-u.ac.jp)
参考文献
1. Fischer A, Le Deist F, Hacein-Bey-Abina S, et al: Severe combined immunodeficiency. A model disease for molecular immunology and therapy. Immunol Rev 203:98-109, 2005.
2. Kohn DB: Gene therapy for childhood immunological diseases. Bone Marrow Transplant 41:199-205, 2008.
3. Antoine C, Müller S, Cant A, Cavazzana-Calvo M, Veys P, Vossen J et al. Long-term survival and transplantation of haemopoietic stem cells for immunodeficiencies: report of the European experience 1968-1999. Lancet 361: 553-560, 2003.
4. Dalal I, Reid B, Doyle J, Freedman M, Calderwood S, Saunders F et al. Matched unrelated bone marrow transplantation for combined immunodeficiency. Bone Marrow Transplant 25: 613-621, 2000.
5. Rao K, Amrolia PJ, Jones A, et al: Improved survival after unrelated donor bone marrow transplantation in children with primary immunodeficiency using a reduced-intensity conditioning regimen. Blood 105:879-885, 2005.
6. Dror Y, Gallagher R, Wara DW, Colombe BW, Merino A, Benkerrou M et al. Immune reconstitution in severe combined immunodeficiency disease after lectin-treated, T-cell-depleted haplocompatible bone marrow transplantation. Blood 81: 2021-2030, 1993.
7. Buckley RH, Schiff SE, Schiff BS, et al: Hematopoietic stem-cell transplantation for the treatment of severe combined immunodeficiency. N Eng J Med 340:508-516, 1999.
8. Bertrand Y, Landais P, Friedrich W, Gerritsen B, Morgan G, Fasth A et al. Influence of severe combined immunodeficiency phenotype on the outcome of HLA non-identical, T-cell-depleted bone marrow transplantation: a retrospective European survey from the European group for bone marrow transplantation and the European Society for Immunodeficiency. J Pediatr 134: 740-748, 1999.
9. Gruhn B, Seidel J, Zintl F, Varon R, T?nnies H, Neitzel H et al. Successful bone marrow transplantation in a patient with DNA ligase IV deficiency and bone marrow failure. Orphanet J Rare Dis 2: 5, 2007.
10. Sanders JE, Hawley J, Levy W, et al, Pregnancies following high-dose cyclophosphamide with or without high-dose busulfan or total-body irradiation and bone marrow transplantation. Blood 87:3045-3052, 1996.
11. Knutsen A, Wall D. Umbilical cord blood transplantation in severe T-cell immunodeficiency disorders: two-year experience. J Clin Immunol 20: 466-476, 2000.
12. Bhattacharya A, Slatter M, Chapman C, Barge D, Jackson A, Flood T et al. Single centre experience of umbilical cord stem cell transplantation for primary immunodeficiency. Bone marrow Transplant 36: 295-299, 2005.
13. K. Imai, H. Kanegane, S. Kumaki, et al. Retrospective analysis of stem cell transplantations for severe combined immunodeficiency in Japan, Bone Marrow Transplant 39, S75, 2007.
14. 金田 眞, 小林良二, 大島淳二郎, 市川瑞穂, 鈴木大介他 BusulfanとFuldarabineを前処置として臍帯血移植を施行した X連鎖型重症複合免疫不全症の3例. 第32回造血細胞移植学会総会 2010年
15. Shimoni A, Hardan I, Shem-Yov N, Rand A, Herscovici C, Yerushalmi R, Nagler A. Comparison between two fludarabine-based reduced-intensity conditioning regimens before allogeneic hematopoietic stem-cell transplantation: fludarabine/melphalan is associated with higher incidence of acute graft-versus-host disease and non-relapse mortality and lower incidence of relapase than fludarabine/busulfan. Leukemia 21: 2109-2116, 2007.
16. Bakker B, Oostdijk W, Bresters D, Walenkamp MJE, Vossen JM, Wit JM. Disturbances of growth and endocrine function after busulfan-based condtioning for haematopoietic stem cell transplantation during infancy and childhood. Bone marrow Transplant 33: 1049-1056, 2004.
17. 日本造血幹細胞移植学会「造血幹細胞移植の適応ガイドライン」